ஈத்தீனோன்
கரிம வேதியியலில், ஈத்தீனோன் (Ethenone) என்பது கீட்டீனின் (Ketene) முறையான பெயர் ஆகும். இது வார்ப்புரு:Chem2 அல்லது வார்ப்புரு:Chem2 வாய்ப்பாட்டுடன் கூடிய கரிமச் சேர்மமாகும். இது கீட்டீன் வகுப்பின் எளிமையான உறுப்பினர் ஆகும். இது அசிடைலேற்றங்களுக்குப் பயன்படும் ஒரு முக்கியமான வினைக்காரணியாகும்.
பண்புகள்
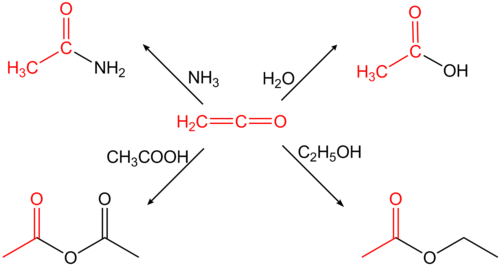
ஈத்தீனோன் மிகவும் வினைத்திறன் கொண்ட வாயுவாகும்.(நிலையான நிலையில்) இந்த வாயு கூர்மையான எரிச்சலூட்டும் வாசனையைக் கொண்டுள்ளது. இது குறைந்த வெப்பநிலையில் மட்டுமே நிலையானதாக இருக்கும் (−80°C). எனவே, பயன்பாட்டிற்குத் தேவைப்படும் போது தயார் நிலையில் இருப்பதற்கு ஏதுவாக அவ்வப்போது தயாரித்துக் கொள்ளப்பட வேண்டும், இல்லையெனில் இருபடியாக்கல் ஏற்பட்டு பலபடிகளுடன் வினைப்பட்டு கையாளக் கடினமாக இருக்கும் பலபடிகளுடன் வினையாற்றுகிறது. தயாரிப்பின் போது உருவாகும் பலபடி உள்ளடக்கம் கீட்டீன் வாயுவில் கந்தக டை ஆக்சைடை சேர்ப்பதன் மூலம் குறைக்கப்படுகிறது. [1] இச்சேர்மத்தின் கூட்டுப்பயனுடைய இரட்டைப் பிணைப்புகளின் காரணமாக, எத்தனோன் அதிக வினைத்திறன் கொண்டதாக உள்ளது. மேலும், தொடர்புடைய அசிட்டிக் அமிலத்தின் வழிப்பொருள்களுக்கு H-அமிலச் சேர்மங்களின் கலவைகளின் சேர்க்கை வினைகளில் வினைபுரிகிறது. எடுத்துக்காட்டாக, இது தண்ணீருடன் வினைபுரிந்து அசிட்டிக் அமிலமாகவும் முதன்மை அல்லது இரண்டாம் நிலை அமீன்களுடன் வினைப்பட்டு தொடர்புடைய அசிடமைடுகளாகவும் மாறுகிறது.
தயாரிப்பு
தொழில்துறை வேதியியலில், அசிட்டிக் அமிலத்தின் நீர் நீக்க வினையால் கீட்டீன் உற்பத்தி செய்யப்படுகிறது:
ஆய்வக அளவில், 200°செல்சியசிற்கும் அதிகமான வெப்பநிலையில் மெல்ட்ரம் அமிலத்தின் வெப்பச் சிதைவு மூலம் இதை உருவாக்க முடியும்.
வரலாறு
500-600°செல்சியசில் சூடான குழாய்கள் அல்லது மின்சாரம் மூலம் வெப்பப்படுத்தப்பட்ட உலோகக் (செம்பு போன்ற) கம்பிகள் வழியாக அனுப்பப்படும் போது கார்பன் டைசல்பைடு முன்னிலையில் , அசிட்டோன் மீத்தேன் மற்றும் எத்தனோனாக சிதைவடைகிறது. இந்த வினையில் 95% விளைபொருள் கிடைக்கும்.[2] 1910 ஆம் ஆண்டில் ஹெர்மன் ஸ்டாடிங்கர் (உலோக துத்தநாகத்துடன் புரோமோஅசிட்டைல் புரோமைடு வினை மூலம்) [3] [4] அசிட்டிக் அமிலத்தின் நீர் நீக்க வினையிலிருந்து தயாரிக்கப்பட்டு கண்டுபிடிக்கப்பட்டது.

அசிட்டிக் நீரிலியின் வெப்பச் சிதைவு வினையும் விவரிக்கப்பட்டது. [5]



இயற்கையில் கிடைக்கும் விதம்
ஈத்தீனோன் விண்வெளியில், வால்மீன்களில் அல்லது விண்மீன்களுக்கு இடையேயான ஊடகத்தின் ஒரு பகுதியாக வாயு நிலையில் உருவாவதாக அறியப்படுகிறது.[6]
பயன்பாடு
அசிட்டிக் அமிலத்திலிருந்து அசிட்டிக் நீரிலியை உருவாக்க எத்தனோன் பயன்படுத்தப்படுகிறது. பொதுவாக இது வேதிச் சேர்மங்களின் அசிட்டைலேற்ற வினைகளுக்குப் பயன்படுத்தப்படுகிறது.
மேற்கோள்கள்
வெளி இணைப்புகள்
- ↑ வார்ப்புரு:Cite patent
- ↑ K.-H.
- ↑ H. Staudinger H. W. Klever (1908): "Keten. Bemerkung zur Abhandlung zur Abhandlung der HHrn. V.T. Wilsmore und A. W. Stewart".
- ↑ Tidwell, T. T. (2005), "Ein Jahrhundert Ketene (1905–2005): die Entdeckung einer vielseitigen Klasse reaktiver Intermediate".
- ↑ Norman Thomas Mortimer Wilsmore (1907): "Keten".
- ↑ வார்ப்புரு:Cite journal